引言
实时定量PCR(Real-time Quantitative PCR,RT-qPCR)是一种高灵敏度的分子生物学技术,用于检测和定量DNA或RNA模板。溶解曲线分析是RT-qPCR实验中一个重要的步骤,它可以帮助我们了解扩增产物的特性和纯度。本文将详细介绍实时定量PCR溶解曲线的设置方法,以及如何正确解读和分析溶解曲线数据。
溶解曲线分析的基本原理
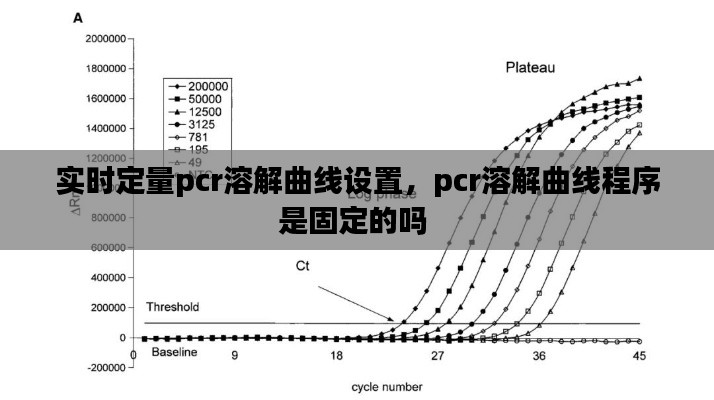
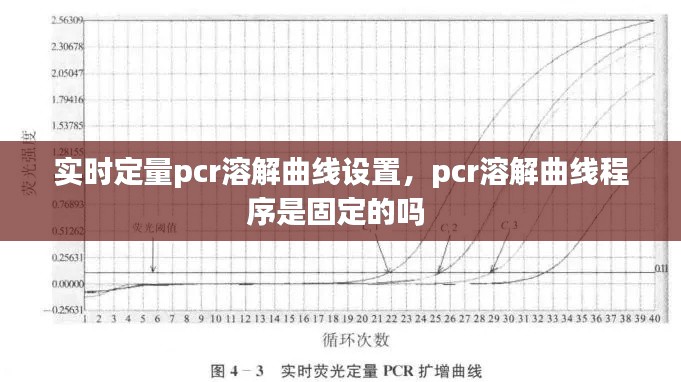
溶解曲线分析是通过加热PCR产物,使其从双链DNA转变为单链DNA,然后记录不同温度下的荧光强度变化。在这个过程中,荧光信号的变化可以反映PCR产物的特性和纯度。溶解曲线的峰型、峰数和熔解温度等参数可以用来判断PCR产物的特异性、纯度和是否存在引物二聚体等。
溶解曲线设置步骤
以下是进行实时定量PCR溶解曲线设置的基本步骤:
准备PCR反应体系:按照常规的RT-qPCR实验步骤,准备PCR反应体系,包括模板DNA、引物、荧光染料、dNTPs、酶和缓冲液等。
设置PCR程序:根据实验目的和模板类型,设置PCR程序。通常包括预变性、变性、退火和延伸等步骤。
进行PCR扩增:将PCR反应体系放入PCR仪中,按照设定的程序进行扩增。
进行溶解曲线分析:在PCR扩增完成后,将PCR产物进行溶解曲线分析。具体操作如下:
将PCR产物放入PCR仪中,设置从60℃到95℃的温度梯度,每个温度点保持5秒。
记录每个温度点的荧光强度,绘制溶解曲线。
溶解曲线分析参数解读
溶解曲线分析主要包括以下几个参数:
熔解温度(Tm):溶解曲线的峰值对应的温度,反映了PCR产物的特异性。Tm值越高,特异性越好。
峰型:溶解曲线的峰型可以反映PCR产物的纯度。典型的溶解曲线峰型为单峰,若出现双峰或多峰,可能存在引物二聚体或非特异性扩增。
峰面积:峰面积与PCR产物的量成正比,可以用于定量分析。
溶解范围:溶解曲线的溶解范围反映了PCR产物的纯度。溶解范围越窄,纯度越高。
溶解曲线分析的应用
溶解曲线分析在RT-qPCR实验中具有广泛的应用,主要包括:
判断PCR产物的特异性:通过比较溶解曲线的峰型和Tm值,可以判断PCR产物的特异性。
评估PCR产物的纯度:通过分析溶解曲线的峰型和溶解范围,可以评估PCR产物的纯度。
检测引物二聚体:通过观察溶解曲线的峰型,可以检测引物二聚体的存在。
定量分析:通过比较溶解曲线的峰面积,可以定量分析PCR产物的量。
结论
实时定量PCR溶解曲线分析是RT-qPCR实验中一个重要的步骤,它可以帮助我们了解扩增产物的特性和纯度。通过正确设置和解读溶解曲线,可以提高RT-qPCR实验的准确性和可靠性。本文详细介绍了实时定量PCR溶解曲线的设置方法,以及如何解读和分析溶解曲线数据,希望对读者有所帮助。












 桂ICP备18009795号-1
桂ICP备18009795号-1